金属有机骨架材料(MOFs)具有超高的比表面积[1], 较高且可调的孔隙率[2], 结构组成多样性[3], 开放的金属位点和化学可修饰等优点[4], 近年来在选择性吸附领域中的应用受到人们的广泛关注[5].目前, 国际上有很多科研组织在研究MOFs[6-7].近年来随着科技水平的快速发展, MOFs材料的结构日益增多, MOFs的种类也逐渐变多,合成难度有所降低.Cu-BTC是一种典型的MOFs材料, 它具有八面体结构, 晶粒大小为2~20 μm, 相比其他MOFs材料, Cu-BTC具有大的比表面积,骨架结构稳定的特点[8], 在280℃加热煅烧不分解, 化学性质稳定, 能长期保存不变质.同时它的制备方法简单, 采用水热法一步合成, 原料成本较低, 具有良好的经济性[9].然而, MOFs的化学和机械稳定性较低, 很大程度上影响了MOFs的应用, 将其固定在支撑体(介孔二氧化硅)上能有效地增强其化学和机械稳定性[10].
介孔二氧化硅具有规则的孔道结构, 非常高的化学稳定性和生物相容性[11],很好的热稳定性[12]; 具有高比表面积和高孔隙率[13]; 颗粒外形规则, 并且可以通过改变合成条件来控制二氧化硅形貌[14]; 其还具有无机组分多样性, 同时可以改性负载各种有机物[15].
本文综合MOFs和SiO2材料的优点, 将Cu-BTC负载于SiO2孔道中, 得到Cu-BTC-SiO2材料, 研究了其对水溶液中亚甲基蓝的吸附性能.
1 实验 1.1 原料与试剂硝酸铜(分析纯, 国药集团化学试剂有限公司); 均苯三甲酸(分析纯, 天津市津北精细化工有限公司); 聚乙二醇(10000, 化学纯, 天津市科密欧化学试剂开发中心); 硝酸(分析纯, 江苏名成化工有限公司); 正硅酸乙酯(分析纯, 天津鼎盛鑫化工有限公司); 氨水(分析纯, 四川西陇化工有限公司); 无水乙醇(分析纯, 利安隆博华(天津)医药化学有限公司); 亚甲基蓝(分析纯, 天津市科密欧化学试剂开发中心).
1.2 仪器UV-2450型紫外-可见分光光度计(日本岛津株式会社),Zeta Plus Zeta电位粒度仪(美国布鲁克海文),XPA-7-G8型光化学反应仪(南京胥江机电厂).
1.3 SiO2的制备在0 ℃下, 将一定量的聚乙二醇加入稀硝酸中搅拌1 h后加入一定量的正硅酸乙酯, 将混合物继续搅拌1 h, 然后在40 ℃下放置3 d, 水洗后在40 ℃ 1mol/L氨水溶液中放置20 h, 在40 ℃干燥24 h后于550 ℃煅烧8 h得到介孔SiO2材料.
1.4 Cu-BTC-SiO2的制备于均苯三甲酸(H3BTC)中缓慢加入一定量的Cu(NO3)2·3H2O, 搅拌后获得蓝色透明溶液, 即为Cu-BTC前驱体溶液.将制得的介孔SiO2置于Cu-BTC前驱体溶液中, 在100 ℃烘箱中放置3 h直到完全透明, 抽滤.将含有SiO2的Cu-BTC前驱体溶液置于120 ℃烘箱中12 h, 使其结晶, 得到Cu-BTC-SiO2.
1.5 Cu-BTC-SiO2的吸附性能实验(1) Zata电位的测定 称取5 mg的样品分别加入到10 mL的pH为3, 5, 7, 9, 11的水溶液中, 超声30 min, 离心10 min, 在室温下静置24 h.用Zata电位分析仪测试样品表面的带电情况, 即Zata电位.
(2) 吸附平衡时间的确定 在25 ℃时, 向30 mL 5 mg/L的亚甲基蓝标准溶液中迅速加入10 mg的Cu-BTC-SiO2, 快速搅拌, 分别于5, 10, 15, 20, 30, 45, 60, 75, 90, 105, 120, 135 min时, 取样离心后取上层清液测定染料吸光度, 直至吸光度不变, 记录不同时间点亚甲基蓝的吸光度, 并算出对应吸附量, 确定吸附平衡时间和最大吸附量.
(3) 不同pH对Cu-BTC-SiO2吸附性能的影响 在25 ℃下, 取5个50 mL烧杯, 分别加入5 mg/L亚甲基蓝溶液30 mL, 分别用浓度均为1 mol/L氢氧化钠, 盐酸的水溶液调节pH至3, 5, 7, 9, 11, 分别加入10 mg的Cu-BTC-SiO2, 震荡2 h, 静置10 min, 取上层清液离心分离后, 用紫外分光光度计测其吸光度.
(4) 不同温度及不同亚甲基蓝浓度对Cu-BTC-SiO2吸附性能的影响 分别在25 ℃, 35 ℃, 45 ℃下, 于5个50 mL烧杯中, 分别加入5 mg/L, 10 mg/L, 15 mg/L, 20 mg/L, 25 mg/L的亚甲基蓝溶液各30 mL和10 mg的Cu-BTC-SiO2, 在振荡器上震荡2 h, 再静置10 min, 用紫外分光光度计测亚甲基蓝在664 nm下的吸光度, 计算吸附率.
1.6 亚甲基蓝的标准曲线配置浓度分别为5, 10, 15, 20, 25 mg/L的亚甲基蓝溶液, 测其原液的吸光度, 绘制标准曲线.据实验测得的数据通过Origin拟合可得到在亚甲基蓝浓度为5~25 mg/L时, 其浓度与吸光度的标准曲线(Y=0.222 9+0.127 02 X).相关系数R2为0.998 5, 可知浓度与吸光度成线性关系, 可根据测得的吸光度计算出平衡浓度Ce, 再根据公式计算平衡吸附量Qe, 即

|
(1) |
式中:Qe为染料的平衡吸附量, mg/g; C0为染料的起始浓度, mg/L; Ce为染料的平衡浓度, mg/L; V为染料的体积, L; m为样品的质量, g.
2 结果与讨论 2.1 不同pH下Cu-BTC-SiO2的Zeta电位分析不同pH下Cu-BTC-SiO2对亚甲基蓝的吸附率曲线如图 1(a)所示, 可以看出pH在3~5和9~11之间时, Cu-BTC-SiO2对亚甲基蓝的吸附率随着pH的增大而增大, 且pH等于5时吸附率最大; 而pH为5~9时Cu-BTC-SiO2对亚甲基蓝的吸附率随着pH的增大而减小.Cu-BTC-SiO2的ζ电位对pH的关系曲线如图 1(b)所示, 当溶液的pH小于5时, Cu-BTC-SiO2的ζ电位为负值且逐渐减小, 当溶液的pH处于5~9时, Cu-BTC-SiO2的ζ电位逐渐增大, 且在8.6~9.2之间时Cu-BTC-SiO2表面带正电; 溶液pH大于9时, Cu-BTC-SiO2的ζ电位又逐渐降低.Cu-BTC-SiO2表面带负电时, 表面的正电位对阳离子染料亚甲基蓝的静电力起主导作用, 使吸附量增加, pH为5时, Cu-BTC-SiO2的ζ电位最低, 其吸附效果最好.pH为9时, 电位正值过大, 影响了材料与染料之间的静电力, 使其吸附量显著降低, 与实验结果一致.
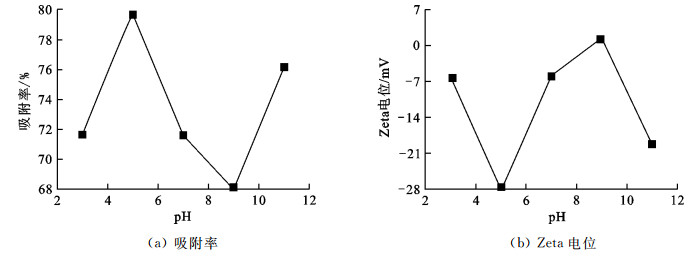
|
| 图 1 不同pH下Cu-BTC-SiO2对亚甲基蓝的吸附率及Zeta电位 Fig.1 Adsorption rate and Zeta potential of Cu-BTC-SiO2 on methylene blue under different pH |
图 2为不同温度下Cu-BTC-SiO2对不同浓度亚甲基蓝的吸附曲线.从图 2可以看出, 相同温度下, 随着浓度的增加, Cu-BTC-SiO2对亚甲基蓝的吸附率不断减小, 以25 ℃为例, Cu-BTC-SiO2对浓度为5 mg/L亚甲基蓝的吸附率能达到77.5%, 而对浓度为25 mg/L亚甲基蓝溶液的吸附率仅为55.7%.相同浓度下, 温度越高, Cu-BTC-SiO2对亚甲基蓝吸附效果越差, 25 ℃时其亚甲基蓝吸附效果最好, 25 ℃时Cu-BTC-SiO2对浓度为5 mg/L亚甲基蓝的吸附率能达到77.5%, 35 ℃时Cu-BTC-SiO2对浓度为5 mg/L亚甲基蓝的吸附率约为74.7%, 而45 ℃时Cu-BTC-SiO2对浓度为5 mg/L亚甲基蓝的吸附率降为72.4%.因此Cu-BTC-SiO2对亚甲基蓝的吸附是放热反应(与热力学计算结果一致).
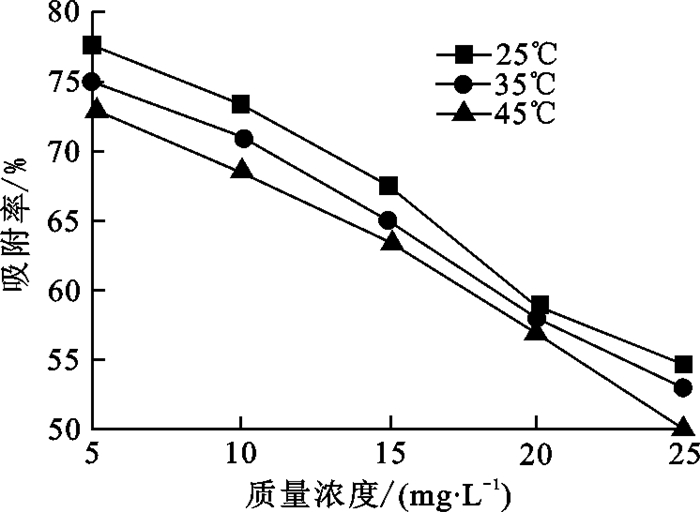
|
| 图 2 不同温度下Cu-BTC-SiO2对不同浓度亚甲基蓝的吸附率曲线 Fig.2 Adsorption rate of Cu-BTC-SiO2on methylene blue at different temperature |
实验采用Langmuir模型[16]和Freundlich[16]模型对等温线进行拟合, 其拟合方程分别为
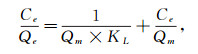
|
(2) |
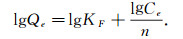
|
(3) |
式中:Ce(mg/L)为亚甲基蓝溶液的平衡浓度; Qe(mg/g)为达到吸附平衡时复合材料对亚甲基蓝的吸附量; Qmax(mg/g)为吸附剂单层饱和的最大吸附量; KL(L/mg)为Langmuir常数; KF(mg/g(L/mg)1/n)和1/n分别为Freundlich吸附常数.
由图 3和表 1可知,其最大吸附量为55.04 mg/g.同时, 对比两个模型的数据可知:Langumuir模型的R2均比Freundlich的R2大, 更接近于1.说明Cu-BTC-SiO2对亚甲基蓝的吸附更适合用Langumuir等温模型描述, 即Cu-BTC-SiO2表面是均匀单层的, 表面上各个吸附位置分布均匀, 发生吸附时焓变相同.只有一种吸附质吸附其上而且被吸附的时候它不会发生解离, 亚甲基蓝之间也不发生相互作用, 发生吸附时的吸附热为常数.

|
| 图 3 拟合的吸附等温线 Fig.3 The fitted adsorption isotherms |
| 温度/℃ | Langmuir | Freundlich | |||||
| Qmax/(mg·g-1) | KL/(L·mg-1) | R2 | KF/(mg·g(L·mg-1)1/n) | 1/n | R2 | ||
| 25 | 55.04 | 0.243 5 | 0.995 5 | 0.011 6 | 1.819 2 | 0.970 2 | |
| 35 | 54.79 | 0.201 6 | 0.999 5 | 0.016 8 | 1.739 9 | 0.974 4 | |
| 45 | 50.00 | 0.204 9 | 0.992 9 | 0.019 6 | 1.726 3 | 0.969 3 | |
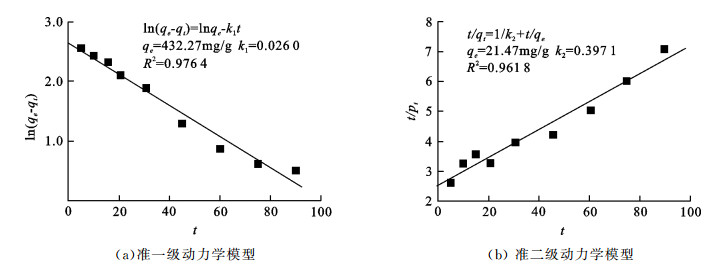
基于固体吸附量的Lagergren(拉格尔格伦)一级速率方程是最为常见的, 应用于液相的吸附动力学方程, 准一级动力学模型是建立在吸附受扩散步骤控制的假设之上的[17].准二级动力学模型是假设吸附速率由吸附剂表面未被占有的吸附空位数目的平方值决定, 吸附过程受化学吸附机理的控制, 这种化学吸附涉及到吸附剂与吸附质之间的电子共用或电子转移[18].分析图 4可知, 两种动力学模型均呈现一定的相关性, 但准一级动力学模型的R2比准二级动力学模型的R2大, 所以Cu-BTC-SiO2对亚甲基蓝的吸附更适合用准一级动力学模型描述.吸附分为3个阶段, 第一阶段为表面扩散过程, 即吸附质到吸附剂表面的扩散; 第二阶段为颗粒内扩散过程, 即吸附质在吸附剂孔隙内的扩散; 第三阶段为平衡阶段[19].
|
| 图 4 拟合的吸附动力学曲线 Fig.4 The fitted adsorption kinetics curve |
吸附过程的热力学特性可以用热力学参数标准吉布斯自由能变(ΔG0)、标准反应焓变(ΔH0)和标准反应熵变(ΔS0)来进行表征, 其与固-液分配系数(Qe/Ce)之间的关系分别为
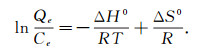
|
(4) |
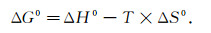
|
(5) |
式中:Qe/Ce为吸附分配系数, L/g; R为理想气体常数; T为实验温度, K.
为了研究Cu-BTC-SiO2对亚甲基蓝吸附的热力学性能, 由热力学方程算出Gibbs自由能(ΔG0, KJ/mol), 吸附热(ΔH0, KJ/mol), 熵(ΔS0, J·mol-1·K-1)等热力学数据, 结果见表 2.ΔH0为负值, 说明亚甲基蓝在Cu-BTC-SiO2上的吸附行为是放热过程, 温度升高不利于反应的进行.ΔS0为负值对应着吸附物种自由度的减少, ΔG0为负值说明Cu-BTC-SiO2对亚甲基蓝的吸附是自发进行的, 且ΔG0的绝对值也随着温度升高而减小, 同样证明升温不利于该反应的进行.在固-液吸附体系中, 同时存在吸附和解吸两个过程, 吸附是熵减过程, 解吸为熵增过程, 吸附过程的熵变为两者之和.实验中Cu-BTC-SiO2对亚甲基蓝的吸附过程的ΔS0 < 0, 表明该过程总的表现为熵减过程.
| T/K | G0/(kJ·mol-1) | ΔS0/(J·mol-1·K-1) | ΔH0/(kJ/mol-1) |
| 298.15 | -5.79 | -94.93 | -12.5 |
| 308.15 | -5.61 | -94.93 | -12.5 |
| 318.15 | -5.53 | -94.93 | -12.5 |
通过原位合成法得到的Cu-BTC-SiO2复合材料, 其对水溶液中的亚甲基蓝表现出较好的吸附效果.25℃时Cu-BTC-SiO2对亚甲基蓝的吸附量为55.04 mg/g, 在25~45 ℃下, Cu-BTC-SiO2对亚甲基蓝的吸附过程符合Langumuir吸附模型.Cu-BTC-SiO2对亚甲基蓝的吸附量随时间变化符合准一级动力学模型.热力学参数表明该吸附行为为放热过程, 且自发进行.
| [1] | ZHOU H C, LONG J R, YAGHI O M. Introduction to metal-organic frameworks[J]. Chem Rev, 2012, 112(2): 673-674 DOI:10.1021/cr300014x |
| [2] | MORI W, TAKAMIZAVVA S. Microporous materials of metal carboxylates[J]. J Solid State Chem, 2000, 152(1): 120-129 DOI:10.1006/jssc.2000.8675 |
| [3] | FARRUSSEN G D, AGUADO S, PINEL C. Metal-organic frameworks:Opportunities for catalysis[J]. Angew Chem Int Ed, 2009, 48(41): 7502-7513 DOI:10.1002/anie.v48:41 |
| [4] | SHU H H, XIU P Y. Metal-organic framework MIL-100 (Fe) for the adsorption of malachite green from aqueous soIution[J]. J Mater Chem, 2012, 22(15): 7449-7455 DOI:10.1039/c2jm16513a |
| [5] | DYBTSEV D N, NUZHDIN A L, CHUN H, et al. A homochiral metal-organic material with permanent porosity, enantioselective sorption properties, and catalytic activity[J]. Angew Chem Int Ed, 2006, 45(6): 916-920 DOI:10.1002/(ISSN)1521-3773 |
| [6] | ROWSELL J L C, YAGHI O M. Strategies for hydrogen storage in metal-organic frameworks[J]. Angewandte Chemic International Edition, 2005, 44(30): 4670-4679 DOI:10.1002/(ISSN)1521-3773 |
| [7] | HORCAJAD A P, SERRE C, VALLETREGI M, et a1. Metal-organic frameworks as efficient materials for drug delivery[J]. Angewandte Chemie, 2006, 45(36): 5974 DOI:10.1002/(ISSN)1521-3773 |
| [8] | JANABI N A L, ALFUTIMIE A, SIPERSTEIN F R, et al. Underlying mechanism of the hydrothermal instability of Cu3(BTC)2 metal-organic framework[J]. Front Chem Sci Eng, 2016, 10(1): 103-107 DOI:10.1007/s11705-015-1552-0 |
| [9] | HONG D Y, HWANG Y K, SERRE C, et al. Porous chromium terephthalate MIL-101 with coordinatively unsaturated sites:Surface functionalization encapsulation, sorption and catalysis[J]. Adv Funct Mater, 2009, 19(10): 1537-1552 DOI:10.1002/adfm.v19:10 |
| [10] | ALEXANDER S, ROB A, BERMARD C, et al. In situ synthesis of Cu-BTC (HKUST-1) in macro-/mesoporous silica[J]. Chem Commun, 2012, 48(39): 4749-4751 DOI:10.1039/c2cc17190b |
| [11] | WANG S N, ZHANG M C, ZHANG W Q, et al. Yolk-shell catalyst of single Au nanoparticle encapsulated within hollow mesoporous silica microspheres[J]. Acs Catalysis, 2016, 1(3): 207-211 |
| [12] | MIYAMOTO M, TAKAYAMA A, UEMIYA S, et al. Study of gas adsorption properties of amidoamine-loaded mesoporous silica for examing its use in CO2 separation[J]. J Chem Eng Jpn, 2012, 45(6): 395-400 DOI:10.1252/jcej.12we006 |
| [13] | CHANG B S, CHEN D, WANG Y, et al. Bioresponsive controlled drug release based on mesoporous silica nanoparticles coated with reductively sheddable polymer shell[J]. Chem Mater, 2016, 25(4): 574-585 |
| [14] | WU S H, MOU C Y, LIN H P. Synthesis of mesoporous silica nanoparticles[J]. Chem Soc Rev, 2013, 42(2): 3862-3875 |
| [15] | SHI Y F, WAN Y, ZHAO D Y. Ordered mesoporous non-oxide materials[J]. Chem Soc Rev, 2011, 40(7): 3854-3878 DOI:10.1039/c0cs00186d |
| [16] | CHATTERJEE S, CHATTERJEE T, WOO S H. Adsorption of congo red from aqueous solutions using chitosan hydrogel beads formed by various anionic surfactants[J]. Sep Sci Technol, 2011, 46(6): 986-996 DOI:10.1080/01496395.2010.538034 |
| [17] | SKODRAS G, DIAMANTOPOLOU I, PANTOLEONTOS G, et al. Kinetic studies of elemental mercury adsorption in activated carbon fixed bed reactor[J]. J Hazard Mater, 2008, 158(1): 1-13 DOI:10.1016/j.jhazmat.2008.01.073 |
| [18] |
黄春桃. 羧甲基壳聚糖-膨润土复合吸附剂对Cu2+、Ni2+、Cr3+的吸附作用研究[D]. 柳州: 广西工业大学, 2012: 7-11.
HUANG C T.Carboxymethyl chitosan-bentonite composite adsorbent deal with heavy metal[D].Liuzhou:Guangxi University of Technology, 2012:7-11. |
| [19] |
邹卫华, 李苛, 高帅鹏, 等. 乙二胺改性锯末对刚果红的吸附研究[J].
郑州大学学报(工学版), 2013, 34(2): 28-31 ZOU W H, LI K, GAO S P, et al. Study on congo red adsorption with ethylenediamine modified sawdust[J]. Journal of Zhengzhou University (Engineering Science), 2013, 34(2): 28-31 |



